Il flavonoide procianidina C1 ha attività senoterapeutica e aumenta la durata della vita nei topi
Astratto
Il declino funzionale degli organi associato all'invecchiamento e l'aumento del rischio di patologie croniche legate all'età è guidato in parte dall'accumulo di cellule senescenti, che sviluppano il fenotipo secretorio associato alla senescenza (SASP). Qui vi mostriamo che la procianidina C1 (PCC1), un componente polifenolico dell'estratto di semi d'uva (GSE), aumenta la durata della salute e la durata della vita dei topi attraverso la sua azione sulle cellule senescenti. Attraverso lo screening di una libreria di prodotti naturali, troviamo che GSE e PCC1 come uno dei suoi componenti attivi, hanno effetti specifici sulle cellule senescenti. A basse concentrazioni, PCC1 sembra inibire la formazione di SASP, mentre uccide selettivamente le cellule senescenti a concentrazioni più elevate, probabilmente promuovendo la produzione di specie reattive dell'ossigeno e la disfunzione mitocondriale. Nei modelli di roditori, PCC1 esaurisce le cellule senescenti in un microambiente tumorale danneggiato dal trattamento e migliora l'efficacia terapeutica quando co-somministrato con la chemioterapia. La somministrazione intermittente di PCC1 a topi vecchi irradiati, impiantati con cellule senescenti o invecchiati naturalmente allevia la disfunzione fisica e prolunga la sopravvivenza. Identifichiamo il PCC1 come un agente senoterapeutico naturale con attività in vivo e un alto potenziale di ulteriore sviluppo come intervento clinico per ritardare, alleviare o prevenire patologie legate all'età.
L'invecchiamento è uno dei maggiori fattori di rischio per i disturbi cronici, comprese le malattie cardiovascolari, i disordini metabolici, le patologie neurodegenerative e diversi tumori maligni, che insieme rappresentano la maggior parte della morbilità, della mortalità e dei costi sanitari a livello globale1. Negli ultimi anni sono stati compiuti notevoli progressi nello sviluppo di agenti specifici per il trattamento di condizioni individuali legate all'età, come il diabete di tipo 2, l'osteoporosi, la fragilità scheletrica e la disfunzione vascolare. Tuttavia, l'effetto combinato di questi farmaci nel controllo della morbilità e della mortalità delle malattie croniche è stato modesto e queste malattie tendono a manifestarsi in sincronia come multimorbilità, con una prevalenza che aumenta esponenzialmente dopo i 70 anni di età.2. Diversi fattori importanti che influenzano la durata della salute e della vita sono stati identificati attraverso studi su una vasta gamma di specie e definiti come meccanismi di invecchiamento che possono essere classificati in nove caratteristiche.3. Di questi meccanismi fondamentali di invecchiamento, la senescenza cellulare ha ricevuto una notevole attenzione, in quanto rappresenta un processo farmacologico che previene o ritarda molteplici comorbidità dell'invecchiamento.4. Riportato per la prima volta negli anni '60, la senescenza cellulare si riferisce a uno stato cellulare che comporta un arresto replicativo essenzialmente irreversibile, profondi cambiamenti della cromatina, resistenza all'apoptosi e aumento della sintesi proteica, che spesso culmina nella sovrapproduzione di citochine pro-infiammatorie, una caratteristica chiamata SASP, che si ritiene guidare i fenotipi dell'invecchiamento e varie patologie legate all'età5. Ablazione di cellule senescenti positive per il marker di senescenza p16INK4A mitiga la degenerazione dei tessuti ed estende la durata della salute degli animali, sostenendo la tesi che le cellule senescenti svolgano un ruolo causale nell'invecchiamento dell'organismo6,7. Il successo negli studi preclinici ha ispirato l'avvio di sperimentazioni cliniche di prova che coinvolgono senolitici per diverse malattie umane con il potenziale di ridurre il carico delle cellule senescenti in vivo attraverso l'eliminazione farmacologica selettiva8,9,10. Dalla prima scoperta nel 2015 (rif. 11), sono ora noti alcuni agenti senolitici sintetici oa piccole molecole. Le strategie di targeting si basano principalmente sul meccanismo di resistenza delle cellule senescenti all'apoptosi, che sembra dipendere da percorsi anti-apoptotici associati alla senescenza che consentono la sopravvivenza delle cellule senescenti per lunghi periodi12,13. La somministrazione intermittente di senolitici ha il potenziale per ridurre il rischio che i pazienti sviluppino condizioni avverse, minimizzare gli effetti fuori bersaglio dei farmaci e prevenire lo sviluppo della resistenza ai farmaci delle cellule senescenti, che non si dividono, una caratteristica che le distingue dalle cellule tumorali, poiché le cellule tumorali acquisiscono frequentemente mutazioni vantaggiose che forniscono resistenza alle terapie antitumorali. Tuttavia, la maggior parte dei senolitici segnalati dipende dalla linea cellulare o dal tipo di cellula o, in alternativa, mostra una sostanziale citotossicità in vivo, limitando così il loro potenziale utilizzo per scopi clinici. In questo studio, abbiamo vagliato una libreria di medicinali di prodotti naturali composta da agenti anti-età e identificato diversi candidati tra cui GSE. Ulteriori analisi hanno rivelato che PCC1, un componente epicatechina trimero di tipo B dei flavonoidi GSE, svolge un ruolo importante nell'inibire l'espressione di SASP a basse concentrazioni e nell'uccidere le cellule senescenti a concentrazioni più elevate, quest'ultima inducendo l'apoptosi. I dati preclinici hanno suggerito che, in combinazione con la chemioterapia classica, la PCC1 può ridurre significativamente le dimensioni del tumore e prolungare la sopravvivenza in diversi modelli murini. Pertanto, PCC1 rappresenta una nuova classe di senolitici fitochimici isolati da fonti naturali che ritardano l'invecchiamento e migliorano i disturbi legati all'età e meritano ulteriori esplorazioni come potenziale agente geroprotettivo nella medicina clinica. Nel tentativo di identificare nuovi composti in grado di modulare efficacemente le cellule senescenti, è stato eseguito uno screening imparziale degli agenti con una libreria fitochimica composta da 46 agenti medicinali di origine vegetale (libreria PDMA). Abbiamo impiegato una linea cellulare stromale della prostata umana normale primaria, PSC27, come modello cellulare per questo scopo. Composta principalmente da fibroblasti ma con una percentuale minore di linee cellulari non fibroblastiche comprese cellule endoteliali e cellule muscolari lisce, PSC27 è una linea cellulare primaria di per sé e sviluppa un tipico SASP dopo l'esposizione a fattori di stress come la chemioterapia genotossica o le radiazioni ionizzanti14,15,16,17. Abbiamo trattato queste cellule con una dose subletale pre-ottimizzata di bleomicina (50 μg ml−1) e hanno osservato un aumento della colorazione della β-galattosidasi (SA-β-Gal) associata alla senescenza, una diminuzione dell'incorporazione di 5-bromodeossiuridina e un aumento dei focolai di riparazione del danno al DNA (DDR) 7-10 giorni dopo (Figura complementare S. 1a – c). Abbiamo messo a punto una strategia di screening per confrontare gli effetti che i singoli medicinali hanno avuto sul profilo di sopravvivenza e di espressione delle cellule senescenti (Dati estesi Fig. 1a). Un vantaggio promettente degli agenti senolitici è quello di indurre selettivamente la morte programmata delle cellule senescenti, come ABT-263, ABT-737 e l'uso combinato di dasatinib e quercetina11,18,19. Abbiamo prima testato l'efficacia di questi farmaci geroprotettivi contro le cellule PSC27 senescenti per dimostrare il suo potenziale come modello cellulare sperimentale per lo screening dei farmaci. I nostri dati preliminari hanno suggerito che ciascuno di questi composti ha significativamente impoverito le cellule senescenti ma non le cellule proliferanti, confermando così la fattibilità dell'uso di questa linea stromale per ulteriori studi (Dati estesi Fig. 1b). Dopo uno screening su larga scala della libreria PDMA, abbiamo identificato diversi composti con il potenziale per uccidere selettivamente le cellule senescenti in coltura (Dati estesi Fig. 1c-mi). Tra gli agenti che mostravano effetti anti-senescenza preliminari c'erano GSE, quercetina, fisetina, curcumina e piperlongumina (Dati estesi Fig. 1d, e). La quercetina e la fisetina condividono strutture chimiche simili, esercitano effetti medicinali simili e sono entrambi noti senolitici11,20,21. Anche la curcumina e la piperlongumina sono composti naturali con potenziale senolitico scoperto di recente22,23. Abbiamo scelto di concentrarci sul GSE, che è rimasto una fonte largamente inesplorata. In condizioni in vitro, il GSE ha soppresso il SASP con la massima efficienza a 0,1875 μg ml−1 (Dati estesi Fig. 2a), che si adatta alla proprietà dei senomorfici24. Concentrazioni più basse o più alte di GSE erano meno efficaci, forse a causa dell'induzione di risposte allo stress cellulare come risultato dell'aumento della citotossicità (Dati estesi Fig. 2a). Utilizzando RNA-seq, abbiamo scoperto che il trattamento con GSE alterava significativamente il profilo di espressione delle cellule della senescenza, con 2.644 geni sottoregolati e 1.472 geni sovraregolati con un cambiamento di piega di 2,0 per gene (P < 0,01) (Dati estesi Fig. 2b). Sebbene l'espressione di alcuni geni non correlati al SASP abbia mostrato una tendenza simile a quella dei tipici fattori SASP (Dati estesi Fig. 2c), i dati della nostra analisi di arricchimento del set di geni (GSEA) hanno supportato una ridotta espressione delle firme molecolari del SASP o l'attivazione del complesso del fattore nucleare (NF)-κB, che è un mediatore chiave del fenotipo pro-infiammatorio (Dati estesi Fig. 2d, e). La traslocazione nucleare di p65, una delle principali subunità del complesso NF-κB, è stata osservata nelle cellule senescenti, coerentemente con il suo impegno funzionale nell'espressione di SASP14 (Dati estesi Fig. 2f). Da notare che questa tendenza è stata sostanzialmente antagonizzata dal GSE a basse concentrazioni (come 0,1875 μg ml−1). Al contrario, l'attivazione della segnalazione NF-κB non è stata soppressa ma è apparsa piuttosto migliorata quando il GSE è stato utilizzato a concentrazioni più elevate (come 3,7500 μg ml−1), suggerendo risposte differenziali delle cellule senescenti in queste condizioni di trattamento. L'attivazione della segnalazione DDR, come evidenziato dalla fosforilazione della chinasi ATM nelle frazioni nucleari, e l'espressione del ligando delle chemochine del motivo C–X–C (CXCL)8, uno dei fattori caratteristici del SASP, come osservato nelle frazioni citoplasmatiche, erano coerenti con NF -κB attivazione in queste impostazioni (Dati estesi Fig. 2f). Il profilo dell'interazione proteina-proteina ha rivelato una rete altamente attiva che coinvolge più fattori significativamente sovraregolati durante la senescenza cellulare ma sottoregolati una volta che le cellule sono state esposte a GSE (Dati estesi Fig. 3a). Il profilo dell'ontologia genica ha rivelato che queste molecole sono funzionalmente impegnate in processi biologici e associate a componenti cellulari generalmente coerenti con la natura secreta del SASP (dati estesi Fig. 3b, c). Pertanto, il GSE è un prodotto naturale che ha il potenziale per controllare il profilo pro-infiammatorio delle cellule senescenti, il SASP, se utilizzato entro un intervallo di concentrazione specifico. Sebbene il GSE non fosse l'unico prodotto naturale con efficacia senolitica nei nostri test cellulari (Dati estesi Fig. 1d, e), il nostro studio successivo si è in gran parte concentrato sul GSE, in quanto la sua capacità geroprotettiva è apparsa particolarmente sorprendente. Data l'efficacia del GSE nel ridurre il SASP come agente senomorfo, abbiamo quindi interrogato il potenziale di questo prodotto naturale nell'uccidere le cellule senescenti a concentrazioni più elevate agendo come senolitico. La colorazione SA-β-Gal ha indicato che le cellule senescenti sono state eliminate a una concentrazione di GSE di 0,75 μg ml−1 (Figura. 1a, b). A 3,75 μg ml−1 GSE, è stato raggiunto un plateau del 20% di sopravvivenza delle cellule senescenti (Fig. 1a, b). un, Quantificazione della sopravvivenza delle cellule PSC27 senescenti mediante positività a SA-β-Gal. Il GSE è stato applicato al mezzo a concentrazioni crescenti. CTRL, cellule di controllo (proliferanti); SEN, cellule senescenti; NS, non significativo. P i valori sono stati calcolati mediante ANOVA unidirezionale con il test di confronto multiplo di Tukey. B, Immagini rappresentative che mostrano la colorazione SA-β-Gal dopo il trattamento di cellule PSC27 con diverse concentrazioni di GSE. Barra della scala, 20 μm. I dati sono rappresentativi di tre esperimenti indipendenti. DMSO, dimetilsolfossido. C, Analisi di sopravvivenza di cellule PSC27 di controllo e senescenti dopo trattamento con GSE (a concentrazioni di 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 e 15,0000 μg ml−1, rispettivamente). I dati sono mostrati come media ± sd e sono stati derivati da tre repliche biologiche (n = 3 saggi indipendenti). P i valori sono stati calcolati da due lati T-test. D, Misurazione del decorso temporale della vitalità in vitro dopo il trattamento di cellule PSC27 di controllo e senescenti con GSE (3,75 μg ml−1). I dati sono mostrati come media ± sd e sono stati derivati da tre repliche biologiche (n = 3 esperimenti indipendenti). P i valori sono stati calcolati da due lati T-test. e, Misurazione in citometria a flusso di cellule PSC27 di controllo e senescenti dopo l'elaborazione con un kit di annessina V-FITC e ioduro di propidio (PI) e colorazione del 4,6-diamidino-2-fenilindolo (DAPI) per determinare l'entità dell'apoptosi. Q1-Q4, quartili 1-4. F, Quantificazione comparativa della percentuale di vitale (Q4, PI−annessina V−) e apoptotico (Q2 e Q3, PI+annessina V+ e PI−annessina V+, rispettivamente) cellule in popolazioni di controllo o senescenti trattate con veicolo o GSE per 3 giorni (n = 3 saggi biologicamente indipendenti). P i valori sono stati calcolati da due lati T-test. G, Misura del segnale di fluorescenza di MitoSOX Red, un indicatore di superossido mitocondriale, in cellule PSC27 in diverse condizioni. P i valori sono stati calcolati da due lati T-test. h, Spettri di massa ad alta risoluzione che mostrano il cromatogramma ionico totale (TIC) e il cromatogramma del picco di base di GSE dopo l'esecuzione di HPLC-ESI-QTOF-MS. Salvo diversa indicazione, le cellule sono state sottoposte ad analisi rilevanti 3 giorni dopo il trattamento con GSE in condizioni di coltura. cps, conteggi al secondo. I dati nei grafici a barre e nelle curve di regressione sono mostrati come media ± ds e sono rappresentativi di tre repliche biologiche. NS, P > 0,05; *P <0.05; **P <0.01; ***P <0,001; ****P <0,0001. I test di vitalità cellulare hanno mostrato che il GSE induce la morte cellulare senescente ma non la morte cellulare proliferante a partire da una concentrazione di 0,75 μg ml−1 (Figura. 1c). Alla concentrazione di 7,50 μg ml−1, la percentuale di cellule senescenti sopravvissute è scesa a circa il 10%, mentre la vitalità delle cellule proliferanti non è stata influenzata nemmeno a 15,00 μg ml−1 GSE (fig. 1c), la più alta concentrazione utilizzata nei nostri test cellulari, suggerendo una selettività e una specificità prominenti del GSE contro le cellule senescenti, che sono i tratti principali dei senolitici. Successivamente abbiamo misurato la capacità del GSE di indirizzare in modo differenziale le cellule senescenti in un andamento temporale. Dopo trattamento con GSE alla concentrazione di 3,75 μg ml−1, la vitalità delle cellule senescenti non è diminuita significativamente fino a dopo 20 h. La differenza di vitalità tra le cellule senescenti e il controllo (cellule proliferanti) ha raggiunto un massimo dopo 32 ore, implicando l'eterogeneità della resistenza intrinseca ai senolitici nelle popolazioni di cellule senescenti (Fig. 1d). Poiché il GSE genera effetti distinti contro le cellule senescenti, abbiamo analizzato l'efficacia del GSE nell'indurre l'apoptosi cellulare. La citometria a flusso ha dimostrato una vitalità significativamente ridotta, mentre l'apoptosi delle cellule senescenti ma non quella delle cellule proliferanti era elevata (Fig. 1e,f e Supplementare Fig. 2a). La disfunzione mitocondriale e i cambiamenti metabolici sono tra i segni distintivi delle cellule senescenti e dell'invecchiamento dell'organismo, eventi che causano stress ossidativo e produzione di specie reattive dell'ossigeno (ROS) come il superossido3,25. Abbiamo usato MitoSOX Red, un indicatore di superossido mitocondriale26, per sondare i cambiamenti intercellulari e ha scoperto che il GSE ha promosso la generazione di ROS mitocondriali nelle cellule senescenti ma non nelle cellule proliferanti (Fig. 1 g). Pertanto, i nostri dati sono coerenti con un modello in cui il GSE uccide le cellule senescenti attraverso l'induzione dell'apoptosi e l'esacerbazione dello stress mitocondriale in vitro. I semi d'uva rappresentano il 38-52%, sulla sostanza secca, dell'uva e costituiscono una copiosa fonte di antiossidanti27. Abbiamo applicato la cromatografia liquida ad alta pressione (HPLC) accoppiata alla spettrometria di massa a tempo di volo a quadrupolo (QTOF-MS) dotata di un'interfaccia di ionizzazione elettrospray (ESI) per identificare i componenti principali del GSE. Abbiamo trovato tre principali categorie di sostanze fitochimiche, inclusi acidi fenolici, flavonoidi (come flavan-3-olo, procianidine) e altri composti (Fig. 1 ora e Tabella Supplementare 1). Tra questi, alcuni componenti sono stati identificati come procianidine e loro derivati, che sono stati segnalati per colpire le proteine mitocondriali e alleviare molteplici malattie croniche28. Tuttavia, i principali componenti che mediano la funzione senolitica del GSE rimangono in gran parte poco chiari. Le attività biologiche riportate delle procianidine dei semi d'uva includono la riduzione del danno ossidativo, la soppressione dell'infiammazione e l'induzione dell'apoptosi delle cellule tumorali29,30,31,32. Tra i singoli composti trovati in GSE, PCC1 merita un'attenzione particolare, poiché è stato dimostrato che induce danni al DNA, provoca l'arresto del ciclo cellulare e aumenta l'espressione delle chinasi del checkpoint33. I dati dell'analisi preliminare (cromatogramma ionico totale) di GSE, una miscela di agenti fitochimici di per sé, mediante HPLC-QTOF-MS hanno suggerito la presenza di PCC1, poiché il profilo di GSE a picchi MS specifici corrispondeva al profilo cromatogramma di PCC1 chimicamente puro acquisito da una fonte commerciale (Fig. 1 ora e Supplementare Fig. 2b). È stato dimostrato che PCC1 riduce il livello di BCL-2 ma aumenta l'espressione del regolatore BAX e le attività delle caspasi 3 e 9 nelle cellule tumorali coltivate, generando così potenzialmente effetti antitumorali attraverso l'induzione dell'apoptosi33. Quindi, abbiamo successivamente valutato la capacità e la selettività di PCC1 per eliminare le cellule senescenti in coltura. I dati suggeriscono che PCC1 è senolitico per le cellule stromali senescenti a partire da una concentrazione di 50 μM, alla quale le cellule proliferanti rimangono in gran parte inalterate (Fig. 2a,b e Tabella Supplementare 2). Sebbene concentrazioni più elevate abbiano causato un tasso di sopravvivenza inferiore delle cellule senescenti, con una soglia approssimativamente a 200 μM, PCC1 ha mostrato tossicità verso le cellule di controllo solo se usato a 600 μM o superiore (Fig. 2b). Un andamento temporale dell'attività della caspasi 3/7 ha indicato che PCC1 ha esercitato effetti apoptotici entro 12 ore, raggiungendo un plateau a 24 ore (Fig. 2c). Questo risultato era in gran parte coerente con le misurazioni della vitalità (Fig. 2d). La natura senolitica del PCC1 è stata confermata dalle cellule che sono entrate nella senescenza a causa dell'esaurimento replicativo o della senescenza (RS) o dell'oncogene (HRASG12V) sovraespressione (OIS), che genera insulti stressanti simili a quelli della senescenza indotta dalla terapia (Fig. 2e, Dati estesi Fig. 4b – e e Tabella Supplementare 2). Insieme, i risultati suggeriscono che PCC1 elimina selettivamente le cellule stromali umane senescenti indotte da diversi stimoli in modo dose-dipendente, ma senza un effetto significativo sulle cellule non senescenti quando viene utilizzato a concentrazioni appropriate. un, Misurazione della sopravvivenza delle cellule PSC27 senescenti mediante colorazione SA-β-Gal. PCC1 è stato applicato a concentrazioni crescenti. P i valori sono stati calcolati mediante ANOVA unidirezionale con il test di confronto multiplo di Tukey. B, Sopravvivenza di cellule PSC27 senescenti indotte da bleomicina a concentrazioni crescenti di PCC1. C, Saggio apoptotico per l'attività della caspasi 3/7. D, Curve di sopravvivenza nel corso del tempo per valutare la vitalità delle cellule PSC27 dopo il trattamento con PCC1. e, Immagini della colorazione SA-β-Gal. TIS, senescenza indotta dalla terapia (da bleomicina). Barra della scala, 20 μm. I dati sono rappresentativi di tre esperimenti indipendenti. F, Citometria a flusso dopo l'elaborazione con un kit di annessina V-FITC e PI e colorazione DAPI per determinare i livelli di apoptosi. G, Quantificazione della percentuale di vitale (Q4, PI−annessina V−) e apoptotico (Q2 e Q3, PI+annessina V+ e PI−annessina V+, rispettivamente) cellule dopo trattamento con veicolo o PCC1 per 3 giorni (n = 3 saggi biologicamente indipendenti). h, Colorazione di immunofluorescenza delle cellule PSC27. La RS è stata indotta dal passaggio seriale prima del trattamento con PCC1. Rosso, p16INK4a. Le cellule a un passaggio precoce (P10) sono state utilizzate come controllo negativo. ABT-263 (1,25 μM) è stato testato come controllo positivo. Barra della scala, 20 μm. io, Statistiche della colorazione con immunofluorescenza. J, Attività senolitica indotta da PCC1 dopo l'inibizione della pan-caspasi (20 μM QVD-OPh). a, test PD di MSC umane. PCC1 è stato applicato l'8° giorno dopo l'inizio degli esperimenti come indicato. BLEO, bleomicina. Per C,D,a, i dati sono mostrati come media ± sd e sono stati derivati da tre repliche biologiche (n = 3 saggi indipendenti). Per i dati in B-D,G,io,J, P i valori sono stati calcolati da due lati T-test. In esperimenti per C-a, PCC1 è stato utilizzato a 100 μM. Salvo diversa indicazione, i campioni sono stati raccolti per le analisi 3 giorni dopo il trattamento con PCC1. I dati nei grafici a barre sono mostrati come media ± ds e sono rappresentativi di tre repliche biologiche. NS, P > 0,05; *P <0.05; **P <0.01; ***P <0,001; ****P <0,0001. Per espandere sperimentalmente e stabilire l'efficacia del PCC1 attraverso le linee cellulari, abbiamo trattato i fibroblasti polmonari fetali umani (WI38), le cellule endoteliali primarie della vena ombelicale umana (HUVEC) e le cellule staminali mesenchimali umane (MSC) con PCC1 e abbiamo scoperto che le cellule senescenti di tutte queste linee hanno mostrato suscettibilità simile per l'ablazione selettiva mediante PCC1, mentre le loro controparti non senescenti sono rimaste vitali (Dati estesi Fig. 4f–h e Tabella Supplementare 3). Abbiamo ulteriormente confermato l'induzione dell'apoptosi nelle cellule senescenti in risposta al PCC1 mediante citometria a flusso, mentre le cellule proliferanti sono rimaste in gran parte inalterate dal PCC1 (Fig. 2f,g). In sintesi, i nostri dati mostrano che PCC1 elimina selettivamente le cellule senescenti attraverso vari tipi di cellule e derivanti da diversi fattori scatenanti della senescenza. Per visualizzare l'esaurimento delle cellule senescenti da parte del PCC1, abbiamo esaminato l'espressione di p16INK4a, un marcatore di senescenza ampiamente utilizzato, nelle cellule stromali che hanno manifestato RS. PCC1 ha rimosso efficacemente le cellule senescenti p16-positive, che sono apparse solo nelle popolazioni PSC27 a passaggio tardivo, con un'efficacia in gran parte simile a quella di ABT-263 (1,25 μM), un noto agente senolitico sintetico18,21 (Figura. 2h, io). Per dimostrare che l'eliminazione delle cellule senescenti mediata da PCC1 avviene principalmente attraverso l'induzione dell'apoptosi, piuttosto che attraverso altre forme di morte cellulare programmata, abbiamo trattato le cellule con l'inibitore dell'apoptosi pan-caspasi chinolil-valil-IL-metilaspartil-(-2,6-difluorofenossi)-metilchetone (QVD-OPh). La capacità di PCC1 di uccidere le cellule senescenti è stata invertita da QVD-OPh. PCC1 condivide quindi la sua induzione di apoptosi dipendente dalla caspasi come caratteristica senolitica con ABT-263 (Fig. 2j). Ulteriori analisi con inibitori chimici hanno escluso la morte cellulare indotta da PCC1 attraverso ferroptosi, piroptosi o necroptosi (dati estesi Fig. 4i). Per valutare il potenziale del raddoppio della popolazione cellulare (PD) dopo il trattamento con farmaci genotossici, abbiamo impiegato le MSC, che possono auto-rinnovarsi e riprendere la proliferazione basata sulle colonie anche dopo l'esposizione a stress ambientali34, probabilmente a causa dell'eterogeneità del danno, con le cellule che subiscono meno danni presumibilmente in grado di mantenere il potenziale per autoripararsi e rientrare nel ciclo cellulare24,35. A differenza delle cellule danneggiate dalla bleomicina, che sono entrate rapidamente in arresto di crescita dopo il trattamento, il trattamento post-senescenza con PCC1 ha migliorato significativamente la capacità PD delle MSC, specialmente dopo la rimozione delle cellule senescenti che sviluppano il SASP e che hanno il potenziale per indurre la senescenza paracrina all'interno delle popolazioni cellulari (Fig. . 2k). Tuttavia, il trattamento con PCC1 non ha influenzato la PD delle cellule proliferanti, ulteriore indicazione della selettività di PCC1 per le cellule senescenti rispetto alle loro controparti normali. Poiché il GSE è una miscela fitochimica complessa, con molti dei suoi componenti aventi attività antiossidante e antinfiammatoria reported27,36, abbiamo studiato se il PCC1 fosse il principale costituente del GSE coinvolto nell'esaurimento delle cellule senescenti o se i fitochimici alternativi nel GSE potessero contribuire al suo effetto senolitico complessivo. A tal fine, abbiamo esaminato l'influenza delle singole molecole fitochimiche sulla sopravvivenza delle cellule PSC27 senescenti. La maggior parte dei componenti del GSE non è riuscita a mostrare attività senolitica nell'intervallo di dose di PCC1 e non ha causato la morte significativa delle cellule proliferanti (Figg. 3 e 4). Sebbene il flavonoide quercetina abbia mostrato attività senolitica come nei nostri studi precedenti, una proprietà condivisa con i flavoni naturali11,21, 'GSE ricostituito', costituito dai componenti principali miscelati in base alla loro percentuale di massa come rivelato dai nostri dati HPLC-QTOF-MS (Tabella supplementare 1, si noti che la quercetina rappresenta solo lo 0,9%) ma escludendo intenzionalmente il PCC1, non ha mostrato risultati simili a quelli osservati per il PCC1 in entrambi i saggi (Figg. 3 e 4). Sebbene non possiamo concludere se altri componenti abbiano un contributo, i nostri dati suggeriscono chiaramente che PCC1 è un mediatore primario dell'effetto senolitico del GSE. Data la notevole efficacia del PCC1 nell'indurre selettivamente la morte delle cellule senescenti, abbiamo interrogato i meccanismi sottostanti. PCC1 appartiene alla superfamiglia dei flavonoidi, in grado di eliminare i radicali liberi, chelare i metalli e ridurre la formazione di idroperossido, proprietà antiossidanti attribuibili al gruppo funzionale '-OH' nella struttura e alla sua posizione sull'anello della molecola flavonoide27. La capacità antiossidante delle procianidine è, in parte, governata dal loro grado di polimerizzazione, mentre PCC1 è per natura un trimero epicatechina di procianidina (Fig. 3a). un, Struttura chimica dell'epicatechina trimerica PCC1. B, Heatmap raffigurante i geni principali (50) significativamente sovraregolati nelle cellule PSC27 senescenti ma sottoregolati dopo il trattamento con PCC1 (50 μM). Stelle rosse, fattori SASP. C, grafico GSEA di un set di geni significativo nello spettro SASP. FDR, tasso di false scoperte; NES, punteggio di arricchimento normalizzato. D, Grafico GSEA di un set di geni significativo associato alla segnalazione mediata da NF-kB. e, Mappa NetworkAnalyst delle interazioni proteina-proteina dei tipici fattori associati a SASP sovraregolati in modo significativo nelle cellule senescenti ma sottoregolati dal trattamento con PCC1. F, Heatmap che mostra l'espressione differenziale dei geni della famiglia BCL-2 in cellule senescenti di controllo, senescenti e trattate con PCC1. G, Immunoblot di cellule PSC27 esposte a diversi agenti. È stata esaminata l'espressione di fattori pro-apoptotici e anti-apoptotici e molecole associate alla segnalazione DDR. Caspasi 3 (t), caspasi 3 totale; caspasi 3 (c), caspasi 3 scissa; p, fosforilata. -actina e GAPDH, controlli di carico. I dati sono rappresentativi di tre esperimenti indipendenti. h, Le cellule sono state infettate con tre diverse specie di RNA a forcina corta che prendono di mira LESIONE o PUMA prima di essere esposto alla bleomicina per indurre la senescenza. Sette giorni dopo, le cellule sono state trattate con PCC1 (100 μM) per un periodo di 3 giorni per indurre l'apoptosi. SCR, scalare. io, LESIONE l'espressione è stata determinata mediante PCR quantitativa con trascrizione inversa (RT-qPCR). Le cellule sono state trattate con bleomicina per indurre la senescenza prima dell'esposizione a 100 μM PCC1 per 3 giorni in assenza o presenza di 10 μM MK2206, 10 μM ruxolitinib o 20 nM BMS-582949 per inibire l'attività di AKT, JAK1 e/o JAK2 o p38 MAPK, rispettivamente. J, Un set simile di saggi di espressione RT-qPCR per PUMA utilizzando le condizioni descritte in io. a-m, Misura della vitalità cellulare dopo trattamento PCC1 in assenza o presenza di MK2206 (a), ruxolitinib (l) o BMS-582949 (m), inclusi per inibire l'attività enzimatica di AKT, JAK1 e/o JAK2 o p38 MAPK, rispettivamente. Per i dati in C,D, P i valori sono stati calcolati mediante ANOVA unidirezionale con il confronto post hoc di Tukey. Significato statistico in h-m è stato calcolato utilizzando due lati T-test o ANOVA unidirezionale (test di Dunnett). I dati in tutti i grafici a barre sono mostrati come media ± ds e rappresentano tre repliche biologiche. NS, P > 0,05; *P <0.05; **P <0.01; ***P <0,001; ****P <0,0001. Per prima cosa abbiamo analizzato l'impatto del PCC1 sull'espressione a livello del trascrittoma delle cellule senescenti. La bioinformatica ha mostrato che 4.406 geni erano significativamente sovraregolati e 2.766 geni erano sottoregolati nelle cellule stromali dopo il trattamento con PCC1 (Fig. 5a). Abbiamo osservato una vasta gamma di fattori SASP, la cui espressione era marcatamente sovraregolata durante la senescenza cellulare ma sostanzialmente sottoregolata quando le cellule senescenti erano esposte a PCC1 (Fig. 3b). Il profilo GSEA ha mostrato che entrambe le firme SASP e NF-κB sono state notevolmente soppresse dal trattamento PCC1 (Fig. 3c, d). Abbiamo inoltre notato molteplici interazioni reciproche o connessioni funzionali tra questi fattori sovraregolati durante la senescenza e sottoregolati dopo il trattamento con PCC1 che compaiono nell'elenco dei principali geni differenzialmente espressi, la maggior parte dei quali erano tipicamente fattori secreti (Fig. 3e). Per comprendere la selettività di PCC1 per le cellule senescenti, abbiamo ulteriormente valutato il profilo di espressione trascrittomica e notato che PCC1 ha indotto cambiamenti di espressione in alcuni membri della superfamiglia BCL-2 (Fig. 3f). Sebbene la segnalazione DDR sia rimasta in gran parte inalterata, è stata osservata una sovraregolazione o attivazione della proteina chinasi attivata dal mitogeno p38 (MAPK) dipendente da PCC, con la scissione della caspasi 3 che si verifica in queste cellule (Fig. 3g). Sebbene l'espressione di BCL-xL fosse elevata nelle cellule senescenti rispetto a quella nei loro controlli proliferanti, il trattamento con PCC1 non ha aumentato ulteriormente il suo livello proteico. I livelli degli altri due fattori BCL-2, vale a dire BCL-2 e BAX, sono rimasti sostanzialmente invariati. Mentre NOXA e PUMA (due membri della sottofamiglia pro-apoptotica BCL-2 solo dominio 3 (BH3)) hanno mostrato diversi modelli di espressione durante la senescenza cellulare, il trattamento con PCC1 ha portato alla sovraregolazione di entrambi i fattori (Fig. 3g). Il knockdown dei fattori pro-apoptotici BCL-2 ha suggerito che NOXA e PUMA mediano parzialmente le azioni senolitiche di PCC1 (Fig. 3h e dati estesi Fig. 5a-c). Il trattamento con inibitori chimici di AKT chinasi, Janus chinasi (JAK)1, JAK2 e p38 MAPK ha suggerito anche il coinvolgimento di queste vie di segnalazione nell'espressione di PMAIP1 (LESIONE) e BBC3 (PUMA) e l'apoptosi delle cellule senescenti dopo il trattamento con PCC1 (Fig. 3i-m). Come abbattere LESIONE e PUMA ha inibito solo parzialmente l'effetto senolitico del PCC1 (Fig. 3 ore, k – m), abbiamo studiato altri possibili meccanismi che portano alla morte delle cellule senescenti. Poiché le procianidine di solito aumentano la vitalità cellulare, diminuiscono la produzione di ROS e limitano lo stress ossidativo nelle cellule di mammifero37,38, ci siamo poi chiesti se si potessero osservare effetti simili o antiossidanti nelle cellule senescenti esposte al PCC1. Sorprendentemente, abbiamo scoperto che era il caso opposto, poiché le cellule PSC27 senescenti mostravano livelli di ROS elevati quando trattate con PCC1, in contrasto con le loro controparti proliferanti (Fig. 4a e dati estesi Fig. 5 D, notare i segnali dalla sonda 2′-7′-diclorodiidrofluoresceina diacetato (DCFH-DA)). Trattamento con HS-1793, un analogo stabile del resveratrolo con attività di scavenging dei radicali liberi39, ha bloccato efficacemente la produzione di ROS in cellule senescenti trattate con PCC1 (Extended Data Fig. 5e, f), mentre i livelli di ROS sono stati ulteriormente aumentati dopo l'esposizione di cellule senescenti trattate con PCC1 a CCCP, un disaccoppiatore mitocondriale protonoforo40, o ruxotemitide (LTX-315), un peptide cationico anfipatico che induce la permeabilizzazione della membrana mitocondriale esterna41, ciascuno applicato a concentrazioni che non erano citotossiche per controllare le cellule (dati estesi Fig. 5e, f). Sebbene il trattamento con CCCP o ruxotemitide di per sé abbia anche causato una maggiore produzione di ROS, gli effetti erano generalmente inferiori a quelli indotti dal PCC1, suggerendo che il PCC1 innesca la disfunzione mitocondriale nelle cellule senescenti. Misurando l'indice apoptotico delle cellule senescenti (attività della caspasi 3/7), abbiamo scoperto che l'effetto indotto da PCC1 potrebbe essere ulteriormente potenziato dalla combinazione di PCC1 con ciascun distruttore mitocondriale ma soppresso dopo il co-trattamento con HS-1793 (dati estesi Fig. . 5g). un, Misurazione dei livelli di ROS con DCFH-DA, una sonda fluorescente permeabile alle cellule sensibile ai cambiamenti nello stato redox cellulare. Gli esperimenti sono stati eseguiti 1 giorno dopo il trattamento con PCC1. A sinistra, immagini rappresentative. Barra della scala, 10 μm. Esatto, le statistiche. DCF, diclorodiidrofluoresceina. B, Immunoblot dopo l'esposizione delle cellule a diversi trattamenti. La distribuzione del citocromo c tra i mitocondri e il citoplasma è stata profilata isolando i mitocondri dai surnatanti del citosol 3 giorni dopo il trattamento con PCC1. COX IV è l'enzima terminale della catena respiratoria mitocondriale e un marker mitocondriale. C, Curve di sopravvivenza nel corso del tempo per valutare la vitalità delle cellule PSC27 dopo il trattamento con PCB2, un altro membro della famiglia delle procianidine naturali. I dati sono mostrati come media ± sd e sono stati derivati da tre repliche biologiche (n = 3 saggi indipendenti). D, saggio di produzione di ROS eseguito in modo simile a quello descritto in un, tranne che le cellule sono state esposte a PCB2. Barra della scala, 10 μm. e, Immunoblot dell'espressione e della distribuzione di ATM, p53 e caspasi 3 tra il citoplasma e il nucleo. GAPDH e lamina A/C, controlli di caricamento per citoplasma e nuclei, rispettivamente. C1, PCC1; B2, PCB2. F, Microscopia confocale della colorazione con immunofluorescenza dopo il trattamento delle cellule con veicolo (DMSO) o PCC1. Sono stati applicati anticorpi primari specifici per p53 o COX IV. Barra della scala, 10 μm. G, Analisi immunoblot di cellule PSC27 esposte a diversi agenti. Cito, citoplasmatico; mito, mitocondriale. h, Analisi della colorazione JC-1, una sonda fluorescente indicativa di Δψm. I segnali sono stati misurati in 3 giorni. La fluorescenza verde indica i monomeri JC-1 (appaiono nel citosol dopo la depolarizzazione della membrana mitocondriale e indicano l'apoptosi in fase iniziale). La fluorescenza rossa indica l'aggregazione di JC-1 (risiede sui mitocondri intatti). A sinistra, immagini rappresentative. Esatto, le statistiche. Sia PCC1 che PCB2 sono stati utilizzati a 100 μM in saggi pertinenti. Dati in B,e-G sono rappresentativi di tre esperimenti indipendenti. Significato statistico in un (Giusto), D (a destra) e h (a destra) è stato calcolato utilizzando due lati T-test, e che in C è stato calcolato con ANOVA unidirezionale (test di Dunnett). I dati in tutti i grafici a barre sono mostrati come media ± ds e sono rappresentativi di tre repliche biologiche. NS, P > 0,05; *P <0.05; **P <0.01. Il rilascio di citocromo c e la rottura della membrana mitocondriale sono eventi intracellulari associati all'apoptosi e spesso agiscono come fattori apoptotici diretti42. I nostri dati suggeriscono che il trattamento con PCC1 ha migliorato il rilascio di citocromo c dai mitocondri allo spazio citoplasmatico circostante (Fig. 4b e dati estesi Fig. 5h). Il rilascio di citocromo c dai mitocondri è in gran parte coerente con reazioni biochimiche come l'attivazione della caspasi nelle cellule senescenti trattate con PCC1 (Fig. 3g). I membri della famiglia delle procianidine mostrano un ampio spettro di proprietà farmacologiche, tra cui l'antiossidazione e l'antinfiammatorio, che sono l'opposto di ciò che abbiamo osservato nel trattamento delle cellule senescenti con PCC1. I dati attuali ci hanno spinto a ragionare se gli effetti del PCC1 sono riprodotti da altre procianidine. La procianidina B2 (PCB2) è un flavonoide rappresentativo che esiste come dimero e riduce i livelli di ROS durante lo stress ossidativo nelle cellule in coltura43. PCB2 non è riuscito a eliminare le cellule senescenti (Fig. 4c e Figg. 3b e 4b) e né una maggiore produzione di ROS né un rilascio mitocondriale indotto del citocromo c nelle cellule senescenti (Fig. 4d e dati estesi Fig. 5i). Una notevole quantità di p65 (RelA), una delle principali subunità del complesso NF-κB, traslocata nel nucleo delle cellule senescenti (Fig. 4e). Sebbene il trattamento con PCB2 abbia neutralizzato la traslocazione nucleare di p65, che è coerente con la sua capacità antinfiammatoria, questo effetto non è stato riprodotto da PCC1 (Fig. 4e). Le cellule senescenti esposte a PCC1 hanno mostrato una notevole scissione della caspasi 3, mentre quelle trattate con PCB2 no, differenziando ulteriormente l'attività biologica di queste due molecole di procianidina (Fig. 4e). Come fattore che governa funzionalmente il destino cellulare, p53 può indurre l'apoptosi transattivando geni pro-apoptotici o in modo indipendente dalla trascrizione traslocando nei mitocondri44. Abbiamo osservato un aumento della traslocazione nucleare di p53 durante la senescenza cellulare, un pattern marcatamente ridotto da PCC1, ma molto meno di quello da PCB2 (Fig. 4e, f). Poiché l'esclusione nucleare di p53 è un passaggio critico nell'induzione dell'apoptosi delle cellule senescenti45, abbiamo ulteriormente valutato la distribuzione di p53. La colorazione dell'immunofluorescenza indicava una sovrapposizione sostanzialmente maggiore di p53 con la subunità IV della citocromo c ossidasi (COX IV) (un complesso proteico transmembrana nella catena elettronica respiratoria mitocondriale, spesso usato come marcatore della proteina residente mitocondriale) nelle cellule senescenti trattate con PCC1, suggerendo una traslocazione potenziata di p53 nella matrice mitocondriale. Sebbene abbiamo osservato alcuni p53 nei mitocondri delle cellule proliferanti, PCC1 non ha indotto un afflusso notevole o completo della proteina p53 nella matrice mitocondriale delle cellule proliferanti (Fig. 4f). Tuttavia, nelle cellule senescenti, i livelli di p53 sono diminuiti nei nuclei ma aumentati nei mitocondri in seguito all'esposizione a PCC1 (Fig. 4g). Il declino del potenziale di membrana mitocondriale (Δψm) è un evento che può innescare l'apoptosi attraverso la via intrinseca mediata dai mitocondri46. Abbiamo scoperto che Δψm era significativamente ridotto nelle cellule senescenti, mentre le cellule proliferanti rimanevano sostanzialmente inalterate in presenza di PCC1, come indicato dal profilo dei segnali della sonda JC-1 (Fig. 4h). Pertanto, PCC1 promuove la generazione di ROS, innesca il rilascio di citocromo c e causa disturbi Δψm nelle cellule senescenti, eventi intrinsecamente associati alla disabilità mitocondriale e alla guida funzionale dell'apoptosi cellulare. Insieme, i nostri dati sperimentali suggeriscono che le cellule senescenti sono soggette ad apoptosi indotta da PCC1, un processo parzialmente mediato da LESIONE e PUMA upregulation e associata a una maggiore produzione di ROS e disfunzione mitocondriale. Data la capacità e la selettività del PCC1 nell'eliminare le cellule senescenti in vitro, abbiamo quindi chiesto se questo agente potesse essere sfruttato per intervenire contro le patologie legate all'età in vivo. In oncologia clinica, la resistenza ai farmaci limita l'efficacia della maggior parte dei trattamenti antitumorali, mentre le cellule senescenti contribuiscono frequentemente alla resistenza terapeutica attraverso lo sviluppo di un SASP in vivo nel microambiente tumorale danneggiato dal farmaco (TME)15,16,47. L'eliminazione farmacologica delle cellule senescenti indotte dalla terapia riduce al minimo gli effetti collaterali della chemioterapia e previene la recidiva del cancro negli animali48. Tuttavia, la fattibilità della deplezione mediata da PCC1 di cellule senescenti da tumori primari per migliorare l'efficacia dei trattamenti antitumorali rimane in gran parte sconosciuta. In primo luogo, abbiamo scelto di costruire ricombinanti tissutali mescolando cellule PSC27 con cellule PC3, che sono una tipica linea cellulare di cancro alla prostata ad alta malignità, in un rapporto pre-ottimizzato (1:4)14. Le cellule sono state quindi impiantate per via sottocutanea nel fianco posteriore di topi con diabete non obeso e immunodeficienza combinata grave (NOD-SCID). I tumori degli animali sono stati misurati alla fine di un periodo di 8 settimane e i tessuti sono stati acquisiti per la valutazione patologica. Rispetto ai tumori che comprendono cellule tumorali PC3 e cellule stromali PSC27 naive, gli xenotrapianti composti da cellule PC3 e cellule PSC27 senescenti hanno mostrato un volume significativamente aumentato, confermando gli effetti di promozione della crescita tumorale delle cellule senescenti (Dati estesi Fig. 6a). Per imitare le condizioni cliniche, abbiamo progettato sperimentalmente un regime preclinico che incorporasse terapie genotossiche e/o senolitici (Fig. 5a). Due settimane dopo l'impianto sottocutaneo, quando è stata osservata una captazione stabile dei tumori in vivo, una singola dose di mitoxantrone (MIT, un farmaco chemioterapico) o placebo è stata somministrata agli animali il 1° giorno della 3a, 5a e 7a settimana fino alla fine del il regime di 8 settimane (dati estesi Fig. 6b). In contrasto con il gruppo trattato con placebo, la somministrazione del MIT ha notevolmente ritardato la crescita del tumore, convalidando l'efficacia del MIT come agente chemioterapico (riduzione del 44,0% delle dimensioni del tumore) (Fig. 5b). In particolare, sebbene la somministrazione di PCC1 di per sé non abbia causato la riduzione del tumore, il trattamento con MIT seguito dalla somministrazione di PCC1 (a 20 mg per kg tramite iniezione intraperitoneale (ip) 2 settimane dopo la prima dose MIT e poi somministrato bisettimanalmente) ha notevolmente migliorato la regressione del tumore (55,2 % di riduzione delle dimensioni del tumore rispetto al solo MIT; 74,9% di riduzione del volume del tumore rispetto al trattamento con placebo) (Fig. 5b). un, Schema illustrativo di un regime preclinico. Due settimane dopo l'impianto sottocutaneo e l'assorbimento in vivo di ricombinanti tissutali, i topi maschi NOD-SCID hanno ricevuto agenti singoli (mono) o combinati (doppio) in un programma metronomico composto da diversi cicli. BLI, imaging a bioluminescenza. B, Profilo statistico dei volumi terminali del tumore. Le cellule PC3 sono state xenotrapiantate da sole o insieme a cellule PSC27 nel fianco posteriore degli animali. C, Valutazione comparativa della senescenza in vivo mediante colorazione SA-β-Gal. I tumori sono stati appena sezionati dopo aver ucciso gli animali e trattati come sezioni congelate per la colorazione istologica. Barre di scala, 200 μm. D, Grafici di violino che descrivono statistiche comparative della colorazione SA-β-Gal nei tessuti tumorali. e, Saggio di trascrizione per l'espressione in vivo di diversi fattori SASP canonici in cellule stromali isolate da tumori. I tessuti di animali xenotrapiantati con cellule sia stromali che cancerose sono stati sottoposti a isolamento supportato da microdissezione di cattura laser e processi successivi. I dati sono rappresentativi di tre repliche biologiche (n = 10 animali per gruppo). I set di dati vengono visualizzati come grafici box-and-whisker, in cui un box si estende dal 25° al 75° percentile con la mediana mostrata come una linea al centro e baffi che indicano i valori più piccoli e più grandi. F, Profilazione dei trascritti SASP nelle cellule stromali. I segnali corrispondenti a ciascun fattore sono stati normalizzati a quelli del gruppo trattato con veicolo. Nota p16INK4a è anche conosciuto come CDKN2A e p21CIP1 è anche conosciuto come CDKN1A. G, Misurazione statistica di cellule con danni al DNA e cellule apoptotiche in campioni biologici raccolti come descritto in un,B. I valori sono presentati come la percentuale di cellule colorate positivamente mediante immunoistochimica (IHC) con anticorpi specifici per l'istone γH2AX o caspasi 3 (clivato). Per B,D-G, P i valori sono stati calcolati da due lati T-test. h, Immagini IHC rappresentative della caspasi 3 (clivate, CC3) alla fine dei regimi terapeutici. Barre di scala, 100 μm. io, Sopravvivenza comparativa dei topi uccisi dopo lo sviluppo di malattie ingombranti avanzate. La durata della sopravvivenza è stata calcolata dal momento dell'iniezione di tessuto ricombinante fino alla morte dell'animale. SM, sopravvivenza media. P i valori sono stati calcolati mediante test log-rank (Mantel-Cox) a due code. Dati in C,h sono rappresentativi di tre esperimenti indipendenti. I dati in tutti i grafici a barre sono mostrati come media ± ds e sono rappresentativi di tre repliche biologiche. Successivamente abbiamo testato se la senescenza cellulare si fosse verificata nei focolai tumorali di questi animali. Non sorprende che la somministrazione del MIT abbia indotto la comparsa di un gran numero di cellule senescenti nel tessuto tumorale. Tuttavia, la somministrazione di PCC1 a questi animali trattati con chemioterapia ha esaurito la maggior parte delle cellule senescenti (Fig. 5c, d). La microdissezione con acquisizione laser seguita da test di trascrizione ha indicato un aumento significativo dell'espressione dei fattori SASP, tra cui IL6, CXCL8, SPINK1, WNT16B (conosciuto anche come WNT16), GM-CSF (conosciuto anche come CSF2), MMP3 e IL1A, una tendenza accompagnata da sovraregolazione del gene che codifica per il marker di senescenza p16INK4a negli animali trattati con chemioterapia (Fig. 5e e dati estesi Fig. 6c). Questi cambiamenti sono stati osservati principalmente nelle cellule stromali, piuttosto che nelle cellule tumorali vicine, implicando la possibilità di ripopolamento delle cellule tumorali residue, che spesso sviluppano resistenza acquisita nella TME danneggiata dal trattamento. Tuttavia, dopo la somministrazione di PCC1, i cambiamenti associati a SASP sono stati in gran parte invertiti, come suggerito dai saggi di trascrizione e dall'RNA-seq (Fig. 5f e dati estesi Fig. 6d). Per studiare i meccanismi alla base dell'espressione di SASP nei topi trattati con MIT, abbiamo sezionato i tumori di animali trattati con questi due agenti 7 giorni dopo la prima dose di somministrazione di GSE, un momento prima dello sviluppo di colonie resistenti. In contrasto con il trattamento con placebo, la somministrazione di MIT ha aumentato il danno al DNA e l'apoptosi, mentre il trattamento con il solo PCC1 non lo ha fatto (Fig. 5g). Tuttavia, quando gli animali trattati con MIT sono stati co-somministrati con PCC1, il danno al DNA e l'apoptosi sono stati significativamente aumentati, il che implica una maggiore citotossicità negli animali che ricevono sia la chemioterapia che i senolitici. Come prova a sostegno, abbiamo osservato un'elevata scissione della caspasi 3, un tipico segno distintivo dell'apoptosi cellulare, quando PCC1 è stato somministrato insieme al MIT (Fig. 5h). Successivamente abbiamo valutato le conseguenze della progressione del tumore confrontando la sopravvivenza di diversi gruppi di animali nel tempo. In questa coorte preclinica, gli animali sono stati monitorati per la crescita del tumore, con malattia ingombrante considerata insorta una volta che il carico tumorale era prominente (dimensione ≥ 2.000 mm3), un approccio impiegato in studi precedenti14,49. I topi che hanno ricevuto il trattamento combinatorio MIT-PCC1 hanno mostrato la sopravvivenza mediana più prolungata, sopravvivendo almeno il 48,1% in più rispetto al gruppo trattato con il solo MIT (Fig. 5i, verde contro blu). Tuttavia, il solo trattamento con PCC1 ha esteso solo marginalmente la sopravvivenza. I nostri dati suggeriscono che la sola somministrazione di PCC1 non modifica la crescita del tumore né promuove la sopravvivenza degli animali, mentre la co-somministrazione di PCC1 con MIT ha effetti sinergici significativi. Da notare che i trattamenti eseguiti in questi studi sembravano essere ben tollerati dagli animali, poiché non sono state osservate perturbazioni significative nei livelli di urea, creatinina o enzimi epatici o nel peso corporeo (dati estesi Fig. 6e,f). Ancora più importante, gli agenti chemioterapici e geroprotettivi somministrati a dosi ottimizzate in questo studio non hanno interferito significativamente con l'integrità del sistema immunitario o l'omeostasi tissutale di organi critici, anche nei topi immunocompetenti (Figura complementare S. 6a-c). Questi risultati supportano la logica secondo cui gli agenti anti-invecchiamento combinati con la chemioterapia convenzionale hanno il potenziale per migliorare la risposta del tumore senza causare una grave tossicità sistemica. Anche un piccolo numero di cellule senescenti può indurre disfunzioni fisiche negli animali giovani50. Abbiamo chiesto se il PCC1 uccide selettivamente le cellule senescenti in vivo e può quindi prevenire la disfunzione fisica. Per rispondere a questa domanda, abbiamo eseguito l'impianto parallelo di fibroblasti embrionali di topo di controllo e senescenti (MEF, 0,5 × 106 cellule per lato) che esprimono costitutivamente luciferasi (LUC+) per via sottocutanea in topi singenici wild-type (WT). Immediatamente dopo l'impianto, gli animali sono stati trattati con PCC1 (a 20 mg per kg tramite iniezione ip) o veicolo (etanolo-polietilenglicole 400-Phosal 50 propilenglicole (PG) alle 10:30:60) per 7 giorni (Fig. 6a). Abbiamo scoperto che le intensità del segnale di luminescenza erano significativamente più basse nei topi impiantati con cellule senescenti e trattati con PCC1 rispetto a quelli nei fratellini trattati con veicolo, sebbene non sia stata osservata alcuna differenza dopo il trattamento dei topi trapiantati con LUC+ cellule di controllo (fig. 6b,c), confermando l'efficacia senolitica del PCC1 in vivo. un, Schema di procedure sperimentali per il trapianto di cellule e test di funzionalità fisica in topi maschi C57BL/6J di 5 mesi. B, Immagini rappresentative che mostrano l'attività della luciferasi in vivo 2 d dopo l'ultimo trattamento dei topi. Barre di scala, 20 mm. C, Luminescenza delle cellule trapiantate come percentuale rispetto ai segnali medi negli animali trattati con veicolo. D-F, Misurazione della velocità massima di camminata (rispetto alla linea di base) (D), resistenza sospesa (e) e forza di presa (F) in topi maschi C57BL/6J di 5 mesi, con test eseguiti 1 mese dopo l'ultimo trattamento. G, Schema del disegno sperimentale per il trapianto e misurazioni della funzione fisica. h-J, Misurazione della velocità massima di camminata (rispetto alla linea di base) (h), resistenza sospesa (io) e forza di presa (J) in topi maschi C57BL/6J di 28 settimane (2 settimane dopo l'ultimo trattamento). a, Curve di sopravvivenza a un anno di animali di 17 mesi impiantati con 0,5 × 106 cellule MEF di controllo e trattate con veicolo (veicolo CTRL) e topi impiantati con 0,5 × 106 cellule MEF senescenti trattate con veicolo (SEN-vehicle) o PCC1 (SEN-PCC1). Punte di freccia rosse, impianto di cellule (al 528° giorno di età) o misurazione della fine della sopravvivenza (890° giorno di età). P i valori sono stati calcolati mediante test log-rank (Mantel-Cox) a due code. l, Quantificazione comparativa del carico di malattia (a sinistra) e del carico di tumore (a destra) (mostrato come mediana con l'intervallo interquartile) dopo l'impianto di cellule senescenti e il trattamento con veicolo o PCC1. m, Causa di morte negli animali che hanno ricevuto cellule impiantate e sono stati trattati con veicolo o PCC1. Per D-F,h-J, i dati vengono mostrati come grafici a scatola e baffi, in cui i riquadri si estendono dal 25° al 75° percentile con la mediana mostrata come una linea al centro e i baffi indicano i valori più piccoli e più grandi. Per C-F,h-J, P i valori sono stati calcolati da due lati T-test. Numero di animali, n = 5 per gruppo per C, n = 10 per gruppo per D-J, n = 27 per a e n = 13 per l,m. NS, P > 0,05; *P <0.05; **P <0.01; ***P <0,001; ****P <0,0001. Successivamente abbiamo studiato se l'uccisione di cellule senescenti impiantate utilizzando PCC1 potesse attenuare gli eventi patologici, in particolare la disfunzione fisica. Il trattamento di animali giovani con PCC1 dopo l'impianto di cellule senescenti per 1 settimana ha impedito il calo della velocità massima di camminata (RotaRod), della resistenza in sospensione (test di sospensione) e della forza di presa (grip meter), cambiamenti osservati entro 1 mese dopo il trattamento del veicolo di un altro gruppo di topi che trasportavano cellule senescenti, coerenti con il potenziale del PCC1 di ridurre la disfunzione fisica (Fig. 6d-f). La somministrazione di PCC1 ha anche impedito la disfunzione fisica che si è verificata negli animali 5 settimane dopo l'impianto di cellule senescenti (Fig. 6g). Nei topi che ospitano cellule senescenti, un singolo ciclo di trattamento con PCC1 di 5 giorni ha migliorato la funzione fisica rispetto al trattamento con veicolo (Fig. 6:00 - g). Da notare che il miglioramento è stato rilevabile 2 settimane dopo il trattamento con PCC1 ed è durato anche per diversi mesi (Dati estesi Fig. 7a,b). In questi due momenti della somministrazione di PCC1 (immediatamente rispetto a 5 settimane dopo l'impianto di cellule senescenti), gli effetti benefici di PCC1 sembravano essere comparabili. I dati suggeriscono che la tempistica della somministrazione di PCC1 può essere flessibile, indicativa della sua potenziale fattibilità clinica. Poiché le procianidine derivate dai semi delle piante di solito hanno emivite di eliminazione <12 h51,52, un miglioramento così sostenuto della funzione fisica dopo un singolo ciclo di trattamento con PCC1 elude la necessità di un trattamento continuo con l'agente senolitico, implicando inoltre che l'attività di PCC1 è sufficiente per prevenire la disfunzione fisica indotta dalle cellule senescenti. Successivamente abbiamo cercato di valutare l'impatto delle cellule senescenti o il beneficio della loro eliminazione negli animali di mezza età. A questo scopo, abbiamo impiegato topi C57BL/6J di 17 mesi, a cui sono stati impiantati MEF di controllo o senescenti. In particolare, la sopravvivenza degli animali portatori di cellule senescenti e che hanno ricevuto il trattamento con veicolo nell'anno successivo è stata significativamente inferiore a quella delle controparti che hanno ricevuto il trattamento PCC1, con un rischio di morte 2,4 volte più elevato (rapporto di rischio, P = 0,0172) (fig. 6k). Tuttavia, il carico di malattia, il carico tumorale alla morte e le cause di morte non erano significativamente differenti tra i topi trattati con il veicolo e quelli trattati con PCC1 (Fig. 6l, m). Questi dati suggeriscono che un piccolo numero di cellule senescenti potrebbe influenzare la sopravvivenza attraverso un processo generale, come accelerare la progressione dell'invecchiamento, piuttosto che causare una patologia specifica o alcune condizioni individuali. L'aumento del carico di cellule senescenti provoca disfunzioni fisiche, una tendenza che è associata alla mortalità di mezza età ma che può essere posticipata dalla somministrazione di senolitici come il PCC1. I senolitici impoveriscono le cellule senescenti in diversi tessuti e organi in varie situazioni fisiopatologiche, la maggior parte delle quali è correlata all'invecchiamento53. Per esaminare ulteriormente l'effetto del PCC1 sulle cellule senescenti negli organismi e sull'invecchiamento dell'organismo, abbiamo selezionato due modelli animali indipendenti di senescenza in vivo, inclusi topi sottoposti a terapia e topi che invecchiano naturalmente. In primo luogo, abbiamo indotto la senescenza cellulare esponendo i topi WT all'irradiazione di tutto il corpo (WBI) a una dose subletale (5 Gy), un passaggio seguito da un trattamento geroprotettivo con PCC1 (20 mg per kg tramite iniezione ip) o veicolo (etanolo-polietilene glicole 400–Phosal 50 PG alle 10:30:60) (una volta alla settimana) (Fig. 7a). Da notare che gli animali che erano stati sottoposti a WBI hanno manifestato un aspetto corporeo anormale, compresi i capelli marcatamente ingrigiti, che, tuttavia, sono stati in gran parte invertiti dalla somministrazione di PCC1 (Fig. 7b,c). Le cellule senescenti SA-β-Gal-positive sono state indotte in vivo in questi animali, come evidenziato dall'aumentata positività alla colorazione nei tessuti cardiaci e polmonari (Fig. 7d, e). Tuttavia, quando abbiamo trattato con PCC1 mediante iniezione ip, la percentuale di cellule SA-β-Gal-positive nei tessuti sezionati è stata significativamente ridotta, a differenza di quella dei topi trattati con veicolo nella fase post-WBI (Fig. 7f,g). Il trattamento PCC1 ha anche ridotto l'espressione dei marcatori di senescenza e un sottoinsieme di fattori chiave SASP rispetto al trattamento del veicolo (Fig. 7h). In sintesi, i dati suggeriscono che PCC1 può eliminare efficacemente le cellule SA-β-Gal-positive, controllare l'espressione di SASP e ridurre al minimo il carico di cellule senescenti in condizioni in vivo nei topi. un, Schema della procedura sperimentale per topi con WBI e test di funzionalità fisica. B, Confronto istantanee di tutto il corpo di topi maschi C57BL/6J che erano ingenui, esposti a WBI seguito da trattamento con veicolo o esposti a WBI e trattati con PCC1, rispettivamente. C, Un'immagine in gabbia di animali descritti in un in condizioni precliniche. D, Immagini rappresentative della colorazione SA-β-Gal del tessuto cardiaco di topi non trattati (naive) e trattati con WBI sottoposti a trattamento con veicolo o PCC1. Barra della scala, 200 μm. e, Immagini rappresentative della colorazione SA-β-Gal del tessuto polmonare dei topi come descritto in D. Barra della scala, 200 μm. F, Statistiche comparative della colorazione SA-β-Gal del tessuto cardiaco degli animali esaminati in D. G, Statistiche comparative della colorazione SA-β-Gal del tessuto polmonare degli animali esaminati in e. h, Misura quantitativa dell'espressione di SASP a livello di trascrizione nei tessuti raccolti da animali trattati nelle condizioni descritte in un. io,J, Misurazione della corsa sul tapis roulant (io) e forza di presa (J) di topi sperimentali. Per F-J, P i valori sono stati calcolati da due lati T-test. a, Analisi di sopravvivenza Kaplan-Meier di topi C57BL/6J esposti a WBI e trattati settimanalmente con veicolo o PCC1, con topi ingenui come controllo non trattato. CI, intervallo di confidenza; FC, rapporto di rischio; DFI, intervallo libero da malattia. P i valori sono stati calcolati mediante test log-rank (Mantel-Cox) a due code. I dati nei grafici a barre sono mostrati come media ± ds e sono rappresentativi di tre esperimenti indipendenti. NS, P > 0,05; *P <0.05; **P <0.01; ***P <0,001; ****P <0,0001. Abbiamo quindi valutato l'impatto dei trattamenti preclinici sui parametri fisici dei topi. Come previsto, il WBI ha significativamente compromesso la capacità di esercizio e la forza muscolare misurata dal tapis roulant e dai test di forza di presa nel gruppo di veicoli (Fig. 7i, j). Al contrario, l'amministrazione del PCC1 ha fornito vantaggi sostanziali, ripristinando queste capacità. Ancora più importante, il trattamento con PCC1 ha aumentato il tasso di sopravvivenza (Fig. 7k). I nostri risultati indicano che l'eliminazione indotta da PCC1 delle cellule senescenti SA-β-Gal-positive potrebbe essere una strategia efficace per alleviare la regressione fisica correlata alla senescenza e ridurre la mortalità in contesti di invecchiamento precoce innescato da fattori di stress ambientali come la terapia citotossica. Successivamente abbiamo cercato di definire l'impatto delle cellule senescenti sulla funzione fisica negli animali che invecchiano naturalmente. A questo scopo, abbiamo trattato topi WT normali di 20 mesi con veicolo (etanolo-polietilenglicole 400-Phosal 50 PG alle 10:30:60) o PCC1 (20 mg per kg tramite iniezione ip) (una volta ogni 2 settimane) per 4 mesi (fig. 8a). La valutazione istologica ha rivelato una percentuale significativamente elevata di cellule senescenti SA-β-Gal-positive nel rene, fegato, polmone e prostata di animali anziani, che è stata invertita dal trattamento con PCC1 (Fig. 8b, do e dati estesi Fig. 8a-fa). I risultati dei test fisici hanno mostrato che il PCC1 allevia la disfunzione fisica migliorando la velocità massima di camminata, la resistenza in sospensione, la forza di presa, la resistenza del tapis roulant, l'attività quotidiana e le prestazioni di equilibrio del fascio degli animali a cui è stato somministrato PCC1 rispetto a quelli trattati con il veicolo (Fig. 8d–i), Il peso corporeo e l'assunzione di cibo sono rimasti sostanzialmente invariati nei topi trattati con PCC1 (Dati estesi Fig. 8g, h). In particolare, l'espressione del SASP era significativamente ridotta in tessuti come i polmoni di topi anziani trattati con PCC1 rispetto a quella del gruppo trattato con veicolo (Fig. 8j), un pattern coerente con una minore secrezione di fattori SASP da parte dei tessuti stromali umani trattati con PCC1 (Fig. 5f). un, Disegno schematico per l'esame fisico di topi maschi C57BL/6J di 20 mesi trattati con PCC1 una volta ogni 2 settimane (bisettimanale) per 4 mesi. B, Immagini rappresentative della colorazione SA-β-Gal dei reni di topi giovani e anziani trattati con veicolo o PCC1. Barra della scala, 200 μm. C, Quantificazione della colorazione SA-β-Gal come descritto in B. I dati rappresentano la media ± sd D-h, Quantificazione della velocità massima di camminata (rispetto alla linea di base) (D), resistenza sospesa (e), forza di presa (F), resistenza del tapis roulant (G) e attività quotidiana (h) di topi maschi C57BL/6J di 20 mesi dopo il trattamento di 4 mesi. io, Quantificazione del tempo necessario per attraversare la trave di equilibrio. I punti dati prima e dopo il trattamento di ciascun animale sono collegati per consentire il confronto diretto degli effetti del trattamento. J, Profilo quantitativo della trascrizione dell'espressione di SASP nei tessuti polmonari raccolti da topi non trattati (6M) di 6 mesi, trattati con veicolo di 24 mesi (veicolo 24M) e topi trattati con PCC1 di 24 mesi (24M-PCC1) . I dati sono mostrati come media ± sd e sono stati derivati da tre repliche biologiche (n = 3 saggi indipendenti). a, Progettazione schematica per l'analisi della durata della vita di topi (entrambi i sessi) a 24-27 mesi di età. l,m, Sopravvivenza post-trattamento (l) e sopravvivenza per tutta la vita (m) curve di animali C57BL/6J trattati bisettimanalmente con PCC1 (n = 91; 48 maschi, 43 femmine) o veicolo (n = 80; 42 maschi, 38 femmine) a partire dai 24-27 mesi di età. n, Massima velocità di camminata e resistenza in sospensione media degli ultimi 2 mesi di vita (n = 10 topi per gruppo) e la durata della vita per i topi più longevi (primi 20) in entrambi i gruppi. Il, Peso della malattia e carico del tumore alla morte. Per entrambi i sessi, n = 60 topi per braccio. Per i maschi, n = 31 per PCC1 e n = 33 per veicolo. Per le femmine, n = 29 per PCC1 e n = 27 per veicolo. Per C-h,J, n = 3 saggi biologicamente indipendenti. I dati vengono visualizzati come grafici box-and-whisker, in cui un box si estende dal 25° al 75° percentile con la mediana mostrata come una linea nel mezzo e i baffi indicano i valori più piccoli e più grandi (D-h,n) o come media ± sd (Il). Due code spaiate T-test (C-J,n,Il) e modelli di regressione a rischio proporzionale di Cox (l,m) sono stati utilizzati per determinare la significatività statistica. Per stabilire il potenziale dell'eliminazione delle cellule senescenti per estendere la durata residua della vita dei topi WT, abbiamo eseguito il trattamento PCC1 a partire da un'età molto avanzata (Fig. 8 mila). I topi che hanno ricevuto la somministrazione di PCC1 (una volta ogni 2 settimane o bisettimanale) a partire da 24-27 mesi di età (equivalente a un'età di 75-90 anni nell'uomo) hanno avuto una durata mediana post-trattamento del 64,2% più lunga (o del 9,4% in più in generale durata della vita) e un minor rischio di mortalità (65,0%, P < 0,0001) rispetto al gruppo trattato con veicolo (Fig. 8l, m). Questi dati indicano che PCC1 può ridurre significativamente il rischio di mortalità associata all'età nei topi anziani. Successivamente ci siamo chiesti se il tasso di mortalità ridotto negli animali anziani fosse associato a un aumento della morbilità in età avanzata. Abbiamo misurato la funzione fisica in topi sperimentali trattati con PCC1 o veicolo mensilmente fino alla morte. Nonostante la durata residua più lunga nei topi trattati con PCC1, la funzione fisica negli ultimi 2 mesi di vita non era significativamente inferiore a quella nei topi trattati con veicolo (Fig. 8n). All'autopsia, l'incidenza di diverse patologie legate all'età, il carico tumorale e la causa di morte non erano significativamente differenti tra i topi trattati con PCC1 e quelli trattati con veicolo (Fig. 8o e dati estesi Fig. 9a,b). Tuttavia, l'espressione del SASP era ridotta negli organi solidi, il che era ampiamente compatibile con il declino dei livelli circolanti di interleuchina (IL)-6, fattore stimolante le colonie (CSF)2 e proteina chemiotattica dei monociti (MCP)1, marcatori SASP rappresentativi nel sangue periferico (dati estesi Fig. 9c – f). Abbiamo anche osservato una ridotta espressione del SASP in CD3+ I linfociti T nel sangue periferico (Extended Data Fig. 9g), una linea cellulare che mostra un robusto aumento di p16INK4a espressione durante l'invecchiamento umano54. Inoltre, il trattamento con PCC1 ha ridotto lo stress ossidativo nei tessuti epatici, come evidenziato da una diminuzione degli addotti del prodotto della perossidazione lipidica 4-idrossinonenale (HNE) e da un aumento del rapporto tra glutatione ridotto e ossidato (Dati estesi Fig. 9h, io), coerenti con le proprietà generali dei flavonoidi, che esercitano attività antiossidante contrastando i radicali liberi e impegnando il sistema di difesa antiossidante55,56. In sintesi, l'agente senolitico PCC1, un componente fitochimico derivato dal GSE (o in alternativa, in minore abbondanza, da prodotti naturali come estratti di cannella, cacao, bucce di mela e corteccia di pino), può ridurre il carico di cellule senescenti ed eventualmente di altre sviluppare un fenotipo pro-infiammatorio e intrinsecamente dipendente da vie anti-apoptotiche associate alla senescenza pro-sopravvivenza e aumentare la durata della vita post-trattamento senza causare un'elevata morbilità nei topi. Con la presente presentiamo la prova di principio che, anche quando somministrata in tarda età, tale modalità terapeutica ha un potenziale notevole per ritardare notevolmente la disfunzione correlata all'età, ridurre le malattie legate all'età e migliorare le condizioni di salute, fornendo così una nuova strada per migliorare salute e durata della vita nella futura medicina geriatrica. L'invecchiamento è un processo essenzialmente inevitabile che causa progressivamente il declino funzionale in quasi tutti gli organismi. La senescenza cellulare, uno stato di arresto permanente della crescita, è recentemente emersa sia come segno distintivo che come motore dell'invecchiamento3,57. Le cellule senescenti si accumulano nei tessuti invecchiati nel tempo e contribuiscono a un elenco crescente di patologie58. L'eliminazione delle cellule senescenti da topi progeroidi o naturalmente invecchiati estende la durata della salute, aumenta la durata della vita e limita i disturbi legati all'età inclusi, ma non solo, l'aterosclerosi, l'osteoartrite e le malattie neurodegenerative59,60,61,62. I recenti progressi negli studi relativi all'età hanno portato alla ricerca di farmaci in grado di colpire selettivamente le cellule senescenti, in particolare una nuova classe di agenti geroprotettivi chiamati senolitici o, in modo meno aggressivo, senomorfici. Ad oggi, sono stati segnalati alcuni senolitici, tra cui dasatinib e quercetina, fisetina, piperlongumina, inibitori della proteina da shock termico (HSP)90 e inibitori della famiglia BCL-2 come ABT-263 (navitoclax) e ABT-737 (rif. 11,12,13,18,19,21,22). Tra questi, gli inibitori di BCL-2 sono i senolitici più utilizzati, sebbene originariamente sviluppati come terapie per il linfoma. ABT-737 prende di mira BCL-2, BCL-xL e BCL-w ma con bassa solubilità e biodisponibilità orale. Più efficace per l'uso in vivo, ABT-263 inibisce principalmente BCL-2 e BCL-xL, mentre provoca frequentemente trombocitopenia. Dati i marcati effetti collaterali di alcuni composti senolitici, è necessario identificare nuovi composti con attività senolitica ma con ridotta citotossicità. In questo studio, abbiamo esaminato una libreria di farmaci basata su PDMA composta principalmente da prodotti naturali con l'obiettivo di identificare nuovi agenti che possono colpire ampiamente le cellule senescenti con efficacia e sicurezza in vivo ottimali. Di conseguenza, abbiamo identificato il PCC1, un agente fitochimico derivato da fonti naturali, come composto senolitico ad ampio spettro. Come vantaggio speciale, PCC1 può agire in alternativa come agente senomorfo per ridurre al minimo l'espressione di SASP se usato a basse concentrazioni. Una caratteristica così vantaggiosa di PCC1 assomiglia in gran parte a quella del GSE, che può generare effetti sia senomorfici che senolitici. Le strategie genetiche e farmacologiche hanno dimostrato una serie di vantaggi derivanti dall'eliminazione delle cellule senescenti per ritardare l'invecchiamento e controllare le malattie. La senescenza cellulare può essere innescata da una varietà di stimoli che vanno dall'attivazione oncogenica, allo stress genotossico, alla risposta infiammatoria e all'esaurimento replicativo. Diversi composti sono identificati come senolitici ad ampio spettro, mentre altri sono selettivi solo contro un certo tipo di cellule senescenti. Le differenze di specificità implicano scelte individuali di senolitici, che dipendono principalmente dal loro uso clinico previsto. Un recente studio ha rivelato l'ouabaina, un composto naturale appartenente alla famiglia dei glicosidi cardiaci, come agente senolitico che può essere utilizzato sia per l'eliminazione delle cellule senescenti che per la terapia del cancro, quest'ultima attuata attraverso un duplice meccanismo d'azione63. In questo lavoro, abbiamo scoperto PCC1 come un altro nuovo senolitico naturale e potente, che induce selettivamente e specificamente l'apoptosi delle cellule senescenti ma con una citotossicità limitata per le cellule in proliferazione.64. Da notare, a concentrazioni più basse, PCC1 inibisce l'espressione di SASP, una proprietà condivisa da alcuni flavonoidi di origine vegetale come l'apigenina e il kaempferolo, che possono agire come senomorfici per limitare l'impatto delle cellule senescenti sulle condizioni legate all'età65,66. Sebbene pochi studi abbiano rivelato un tale duplice meccanismo di agenti naturali nel prendere di mira le cellule senescenti, la superficie della quercetina recentemente sintetizzata ha funzionalizzato Fe3IL4 le nanoparticelle hanno mostrato potenziale sia senolitico che senomorfo nei fibroblasti umani migliorando l'attività della proteina chinasi attivata da AMP (AMPK)67. Il meccanismo con cui PCC1 ottiene effetti senolitici appare complesso e richiede ulteriori studi. I nostri dati suggeriscono che PCC1 altera l'integrità funzionale dei mitocondri, compromettendo Δψm, portando ad un aumento della produzione di radicali liberi come ROS e causando il rilascio di citocromo c nelle cellule senescenti ma non nelle cellule proliferanti. Una possibile ragione di questa specificità è che le cellule senescenti tendono a sviluppare una membrana plasmatica depolarizzata e hanno concentrazioni aumentate di H+ (rif. 64), una caratteristica che potrebbe renderli più suscettibili all'azione del PCC1. Da notare che queste alterazioni sono accompagnate da un'espressione sovraregolata di fattori pro-apoptotici, in particolare NOXA e PUMA, eventi che promuovono anche in modo critico l'apoptosi delle cellule senescenti. All'interno della famiglia delle procianidine, i cui membri sono noti per derivare dalla polimerizzazione di molecole di flavan-3-olo ed esistono come oligomeri o polimeri28, PCC1 sembra essere funzionalmente unico. I nostri dati sperimentali implicano una notevole differenza tra PCC1 (un trimero) e altre procianidine (la maggior parte delle quali sono infatti monomeri o dimeri, come PCB2). Poiché non abbiamo analizzato in modo completo i membri della famiglia delle procianidine, se il numero di monomeri nella molecola determina il suo potenziale anti-senescenza rimane una domanda aperta ma intrigante e i meccanismi sottostanti meritano studi continui in futuro. La senescenza cellulare di per sé è un processo altamente eterogeneo che dipende da diverse origini cellulari e stimoli ambientali68. Una delle caratteristiche chiave del PCC1 è la sua capacità di eliminare in modo efficiente le cellule senescenti in un ampio spettro di tipi di cellule e fattori di stress, tra cui replicazione, oncogeni, irradiazione e chemioterapia. In questo studio, abbiamo confrontato PCC1 con altri senolitici segnalati per gli effetti su cellule stromali umane, fibroblasti, HUVEC e MSC, i principali tipi di cellule nel microambiente tissutale. Come riportato, ABT-263 elimina i fibroblasti embrionali umani (HEF) e gli HUVEC senescenti ma ha scarso effetto sui pre-adipociti umani12,18. L'uso combinato di dasatinib e quercetina può esaurire tutti e tre i tipi di cellule senescenti in modo dose-dipendente, ma è tossico per le cellule in proliferazione11,69,70. La fisetina, un altro flavonoide naturale segnalato come agente senolitico, mostra effetti modesti su HEF e pre-adipociti senescenti solo ad alte concentrazioni20,21. Al contrario, PCC1 ha il potenziale per superare queste limitazioni, inclusa la dipendenza dal tipo di cellula, l'elevata tossicità nelle cellule non senescenti e la bassa efficienza contro le cellule senescenti. Sebbene, quando usata da sola, la quercetina (un altro flavonoide nel GSE) di per sé mostri citotossicità contro le cellule stromali senescenti, la sua efficacia è generalmente inferiore a quella del PCC1 (confronta Fig. 2a,c e Figg. 3n e 4n). Insieme, PCC1 ha un'attività senolitica superiore con elevata specificità ed efficienza per una gamma più ampia di tipi di cellule rispetto a molti senolitici segnalati come ABT-263, dasatinib, quercetina e fisetina e può colpire le cellule senescenti generate da diversi tipi principali di induttori della senescenza. Abbiamo scoperto che PCC1 esercita un effetto che induce l'apoptosi sulle cellule senescenti in condizioni in vivo. PCC1 ha eliminato efficacemente le cellule senescenti indotte dalla terapia e ridotto i marcatori di senescenza negli organi solidi, evidenziandone l'efficacia in vivo. In questo studio, abbiamo anche trattato topi invecchiati naturalmente con PCC1 e ne abbiamo testato gli effetti sulle cellule senescenti, sull'infiammazione cronica e sulla funzione fisica. Innanzitutto, il trattamento con PCC1 ha impoverito le cellule senescenti in più tessuti e ha ridotto le firme associate a SASP, come mostrato dall'analisi GSEA. In secondo luogo, il PCC1 potrebbe sopprimere l'espressione dei geni associati a SASP nei fegati e nei reni anziani e ridurre l'infiammazione cronica di basso grado nel sangue. In terzo luogo, PCC1 ha alleviato la funzione motoria compromessa, l'equilibrio, l'esercizio esausto, la forza muscolare e l'esplorazione spontanea nei topi anziani. Più importante, le prestazioni su RotaRod e il test dell'equilibrio del fascio nel gruppo trattato con PCC1 sono state migliorate rispetto a quelle nella condizione di pretrattamento iniziale. Complessivamente, il composto fitochimico PCC1 colpisce selettivamente le cellule senescenti nel microambiente tissutale e genera notevoli effetti biologici nei topi invecchiati naturalmente. Simile alle controparti sintetizzate chimicamente, le procianidine di derivazione naturale manifestano attività antinfiammatorie, antiartritiche, antiallergiche e antitumorali, eliminano i radicali liberi dell'ossigeno e sopprimono l'attività di perossidazione indotta dalle radiazioni36,71. Come trimero di epicatechina isolato da materiale vegetale, in particolare dai semi d'uva, è stato dimostrato che PCC1 fornisce benefici per la salute in condizioni patologiche croniche72. Tuttavia, una valutazione approfondita degli effetti tossicologici del PCC1 in vivo è fondamentale per una potenziale applicazione clinica. I nostri dati hanno mostrato che il trattamento con PCC1 (bisettimanale) ad alta concentrazione (20 mg per kg) e ad alta frequenza non presentava tossicità sistemiche apparenti. In sintesi, il nostro studio dimostra la superiorità e la relativa sicurezza di una strategia geroprotettiva che mira selettivamente alle cellule senescenti nei tessuti invecchiati o danneggiati dal trattamento attraverso un ampio spettro di tipi cellulari. Tuttavia, è possibile che le concentrazioni di PCC1 in vivo varino tra gli organi e dipendano dalla dose somministrata, dalla farmacodinamica e dalla farmacocinetica e che le concentrazioni locali non siano sufficientemente elevate da ottenere un effetto senolitico in alcuni tipi di tessuto. In questo caso, Nel complesso, il nostro studio apre una nuova strada per estendere la durata della salute e prolungare la durata della vita e trattare le patologie legate all'età con un agente senoterapeutico (con potenziale sia senomorfo che senolitico), che deriva da fonti naturali e possiede un'efficacia pronunciata. I potenziali effetti anti-invecchiamento del PCC1 dimostrati nei nostri test preclinici forniscono un buon supporto per un ulteriore sviluppo traslazionale e clinico del PCC1, con l'obiettivo generale di raggiungere una vita più lunga e più sana.Principale
Risultati
Basse concentrazioni di GSE limitano l'espressione di SASP
Il GSE ha attività senolitica ad alte concentrazioni
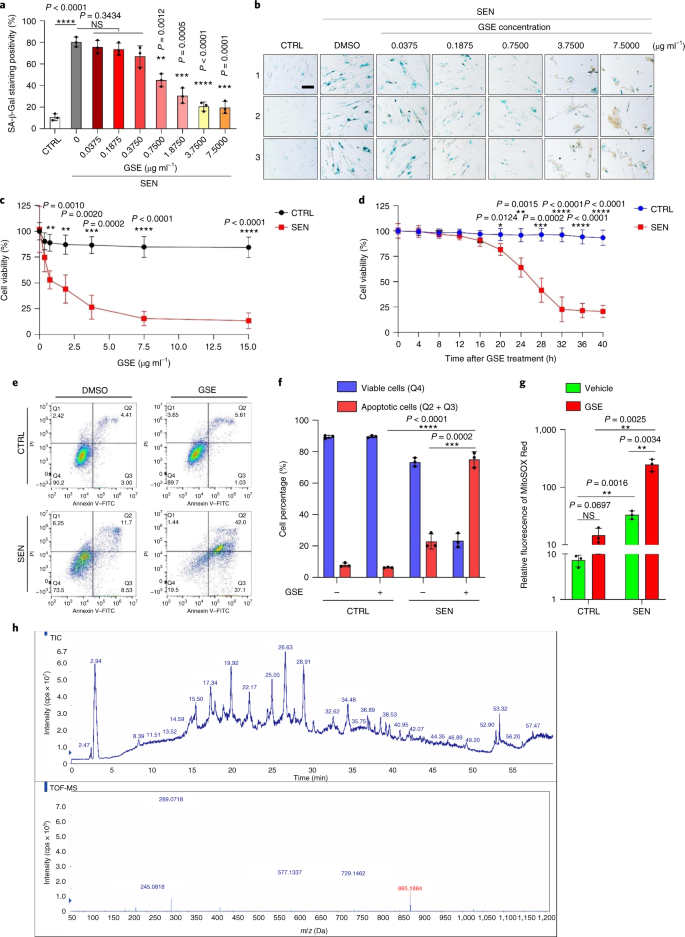
Il componente PCC1 del GSE ha attività senolitica
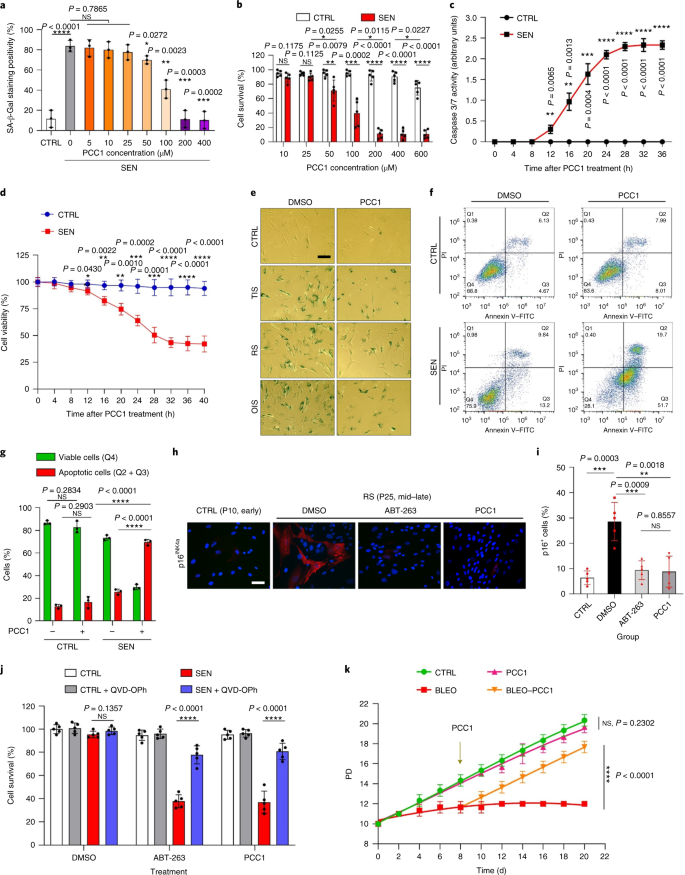
PCC1 induce disfunzione mitocondriale nelle cellule senescenti
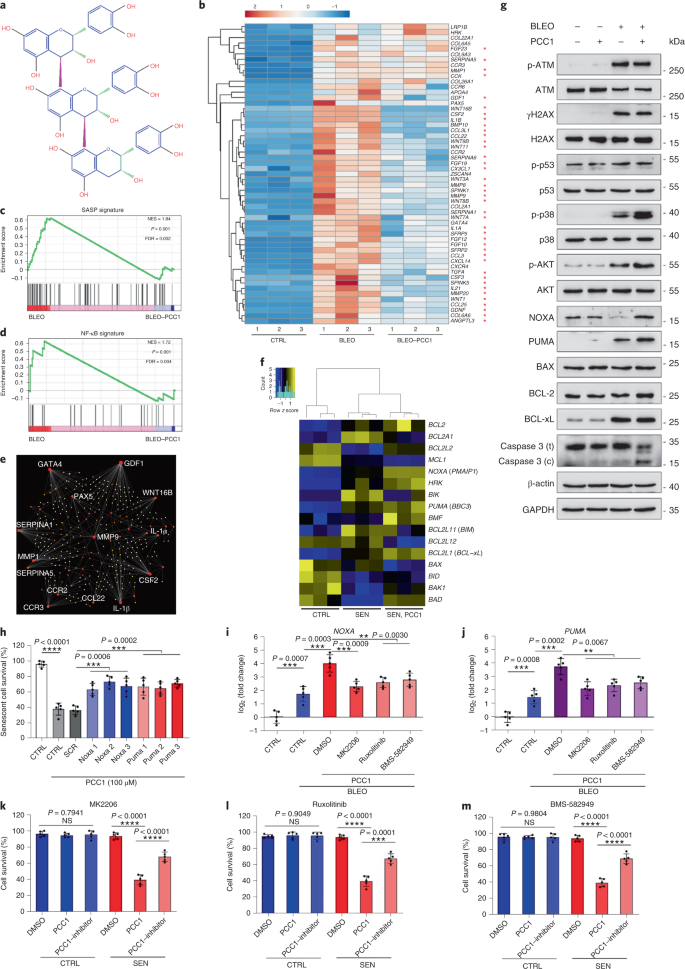
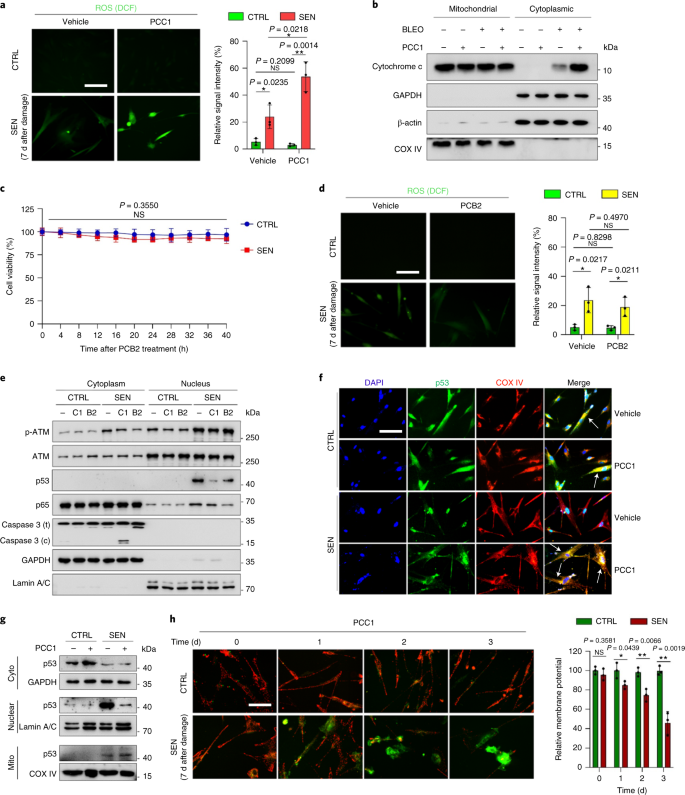
PCC1 promuove la regressione del tumore e riduce la chemioresistenza

La rimozione delle cellule senescenti a seguito del trattamento PCC1 allevia la disfunzione fisica
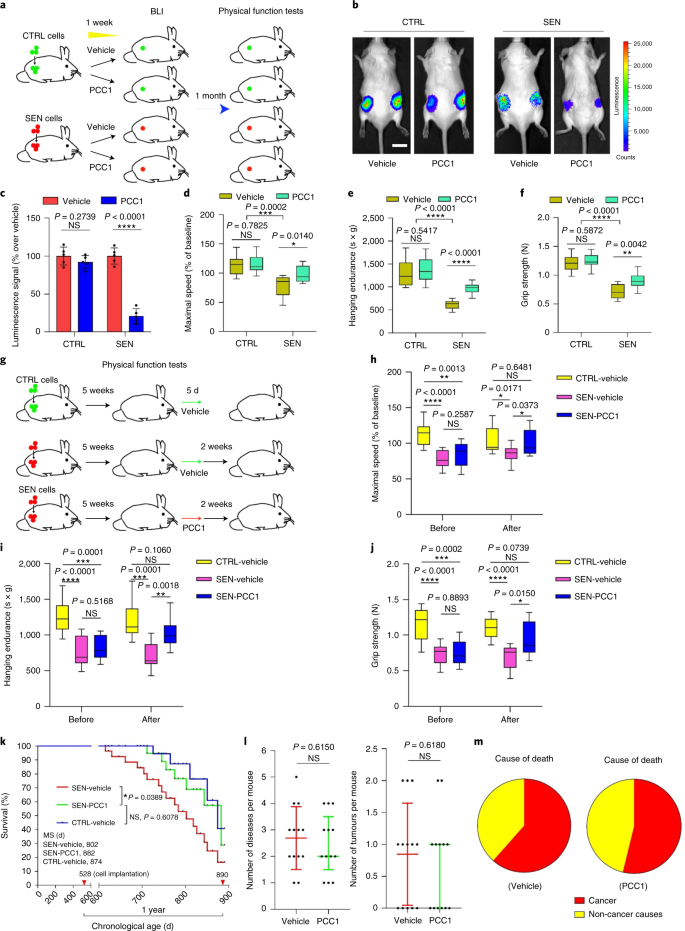
PCC1 sostiene la funzione fisica e prolunga la sopravvivenza dei topi anziani
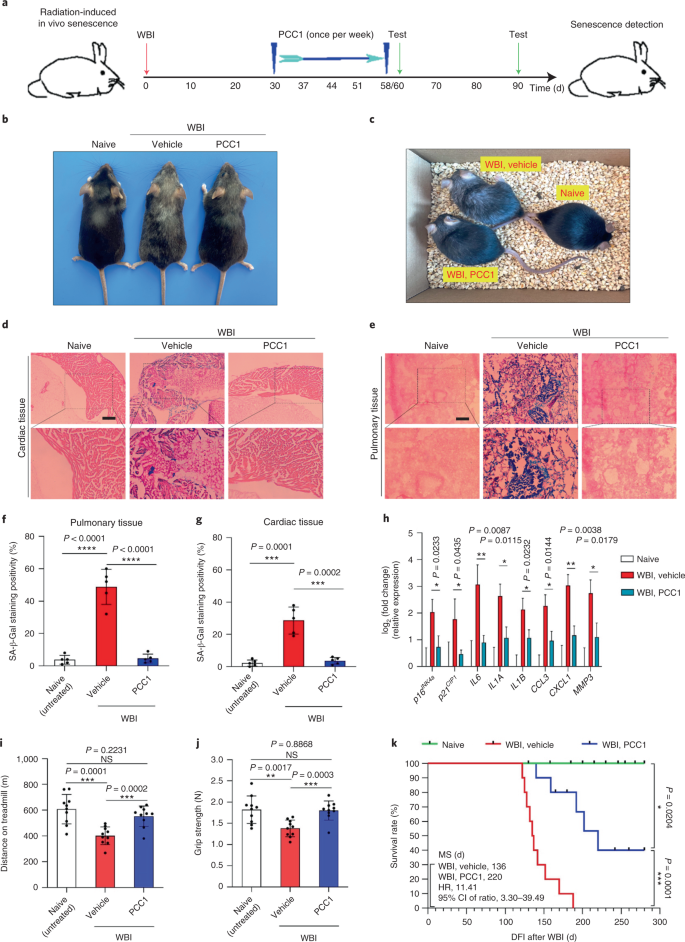
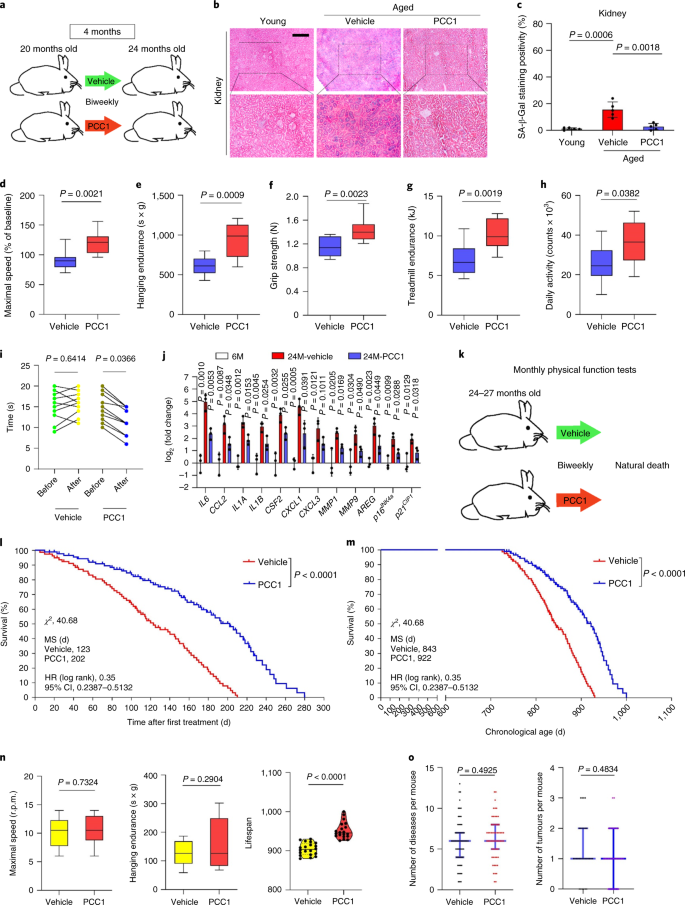
Discussione




